Cómo la impresión 3D de órganos se está transformando en el futuro de los trasplantes
Este tipo de tecnologías permitiría resolver la falta de donantes y los problemas de biocompatibilidad. Los avances que se hicieron a la fecha y los desafíos que restan superar
 7 minutos de lectura'
7 minutos de lectura'

En la Argentina, más de 7400 personas esperan un trasplante de órgano. En lo que va del año se realizaron 988 intervenciones de este tipo y apenas 452 donaron sus órganos este 2022, según datos del Incucai. La brecha entre los pacientes que necesitan recibir un órgano y las donaciones es abismal. La situación se replica, en mayor o menor medida, en diferentes partes del mundo. En este contexto, aplicar soluciones para generar órganos a la medida de las necesidades de los pacientes resulta crucial.
Afortunadamente hace ya algunos años que se viene trabajando en la bioimpresión para paliar los dos grandes problemas mencionados: falta de donantes y los problemas de compatibilidad.
La bioimpresión se refiere a la fabricación, por medio de impresoras 3D, de estructuras complejas compuestas de células y otros biomateriales. Esta técnica permite replicar tejidos e incluso órganos que podrían ser usados para trasplantar a seres humanos.
Cómo funciona la bioimpresión de órganos
El primer paso del proceso de bioimpresión es la extracción de células del paciente que luego se ponen en un recipiente externo, con nutrientes, para que se expandan o reproduzcan. Así se produce una biotinta que tiene células vivas y otros componentes como proteínas, colágeno y ácido hialurónico, que imitan la matriz extracelular, que cumple un rol importante en la multiplicación celular, entre otras funciones.
El médico peruano Anthony Atala, fundador del Instituto Wake Forest para Medicina Regenerativa, es uno de los pioneros en el rubro. En 2006 el investigador, junto con su equipo, fue el primero en desarrollar una vejiga bioimpresa en laboratorio, que luego trasplantó a un joven que padecía espina bífida, una afección que puede causar problemas en el funcionamiento de la vejiga.
En la actualidad, Atala está abocado a la medicina regenerativa para el reemplazo de órganos y tejidos. De hecho, en el último tiempo ha desarrollado varios modelos experimentales para, en un futuro, lograr fabricar riñones en laboratorio.

Por su parte, en 2019, el doctor Tal Dvir, director del centro de nanociencia y nanotecnología de la universidad de Tel Aviv, fue el primero en presentar un pequeño corazón impreso en 3D a partir de células humanas. “Ahora estamos trabajando en la maduración de los corazones impresos. Lamentablemente, los resultados aún no se han publicado, por lo que no puedo compartirlos. También estamos trabajando en la impresión 3D de tejidos renales, retina y demás”, explica Tal Dvir, en diálogo con LA NACION.
Y añade que el principal desafío en este rubro es “lograr hacer madurar los órganos impresos en el laboratorio para que podamos obtener un órgano completamente funcional y escalar desde (un corazón) del tamaño de un conejo hasta el tamaño de un humano”.
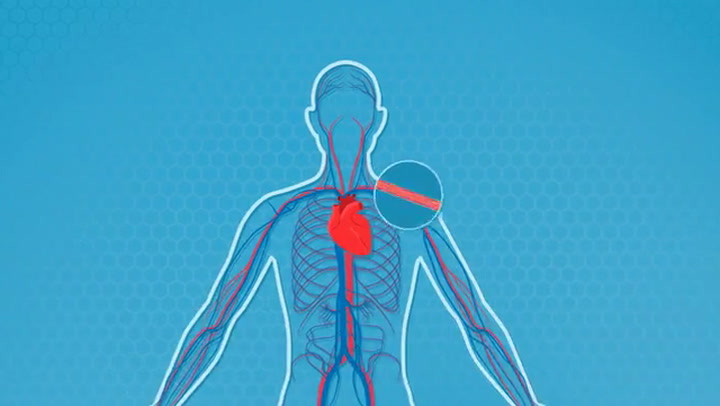
Según el investigador, en los próximos años se podrán hacer trasplantes de estructuras simples como huesos, cartílagos y piel. Y destaca que la compañía Matricelf, de la cual forma parte, está trabajando en el desarrollo de implantes de médula espinal. “Esperamos estar realizando ensayos clínicos en 2 o 3 años”, concluye.
Las técnicas de bioimpresión han ido avanzando, pero todavía no se ha logrado obtener órganos complejos que sean 100% funcionales, y aptos para ser utilizados en humanos, advierte el doctor Guillermo Ulises Ruiz-Esparza, que es mexicano y actualmente desarrolla tecnologías médicas en la Escuela de Medicina de Harvard y el Instituto Tecnológico de Massachussets (MIT).
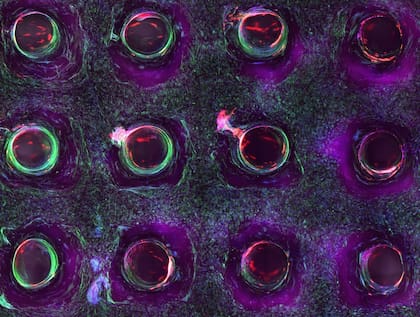
“Uno de los retos que existen hoy en día en el momento de tratar de bioimprimir a una escala mayor es que los tejidos complejos, como por ejemplo un riñón, están compuestos de diferentes tipos de células, capas, estructuras y componentes de la matriz extracelular. Debido a esto, están surgiendo nuevas técnicas de bioimpresión de alta definición basadas en inyección de múltiples biotintas y materiales de manera simultánea”, señala el especialista.
Ruiz-Esparza cuenta que se desempeñó en varios trabajos colaborativos para crear nuevas técnicas de bioimpresión de tejidos. “Entre las investigaciones que he participado destaca una junto con el Dr. Ali Khademhosseini del Terasaki Institute y el Dr. Shrike Zhang de la Universidad de Harvard, en la que se diseñó un nuevo sistema basado en microfluídica con la capacidad de bioimprimir múltiples materiales simultáneamente permitiendo la potencial fabricación de tejidos más complejos como lo son vasculatura, interfaces entre tejido muscular, tendones y ligamentos, etc.”, dice.
Además, aclara que esta plataforma podría utilizarse no solo para tejidos, sino también para fabricar órganos multicapa como podría ser un corazón, debido a su resolución y capacidad de usar múltiples materiales.
En esta disciplina, se destaca también el trabajo de Jennifer Lewis, profesora del Instituto Wyss de la Universidad de Harvard, que se dedica al desarrollo de arquitecturas microvasculares para el cultivo celular y la ingeniería de tejidos. Junto con su equipo de investigación, Lewis creó una plataforma de bioimpresión que permite la fabricación de tejidos 3D compuestos por múltiples tipos de células, matrices extracelulares diseñadas y vasculatura. Estos tejidos vascularizados están en desarrollo para la reparación y regeneración de tejidos, entre otros usos.
Bioimpresión para la regeneración de tejidos
En el marco de la medicina regenerativa, que busca asistir al cuerpo para que este se regenere por sí solo, se plantea colocar una especie de “andamio” o matriz extracelular artificial, por el cual las células se puedan desplazar y proliferar. Esos andamios -que se pueden fabricar de diferentes maneras, entre ellas por medio de impresora 3D- permiten que se regenere el tejido sobre el propio paciente.
“Esto ahorra el laboratorio de cultivo y podría permitir que en el mismo proceso quirúrgico se pudiera poner este componente sembrado con las células del paciente. De este modo se reducen gastos y tiempos quirúrgicos, además de favorecer la recuperación del paciente”, resume la doctora Élida Beatriz Hermida, especialista en biomateriales y desarrollo de aplicaciones biomédicas. Hermida es docente e investigadora de la Escuela de Ciencia y Tecnología, de la Universidad Nacional de San Martín (Unsam).
En dicho laboratorio, la doctora y su equipo han trabajado en la impresión 3D con filamentos plásticos para la regeneración ósea y de cartílagos. En el primer caso, la investigación se ha dado solo in vitro, en tanto que en el caso de los cartílagos se está avanzando en el desarrollo de productos para la regeneración de vías aéreas superiores tanto en adultos como en pacientes pediátricos.
Por otra parte, están trabajando en una biotinta para la regeneración de piel por impresión 3D, una investigación que está en estadio de pruebas in vitro. “Se están usando hidrogeles (pueden ser a base de gelatina, alginato, quitosano, colágeno, ácido hialurónico, entre otras moléculas) cuya viscosidad, rigidez y otras propiedades estructurales pueden adecuarse al tejido a regenerar. Es una masa de cierta viscosidad que se pone en una jeringa, no son filamentos”, detalla la investigadora.
Y añade: “Más del 90% del hidrogel es agua o medio de cultivo (que es un medio líquido que posee nutrientes para las células). Se imprime el andamio y luego se disponen células del paciente sobre ese andamio o se lo ubica en la zona a regenerar para que sea colonizado por las células del entorno. A futuro se podría directamente poner células en la jeringa e imprimir con una biotinta (hidrogel con células) y esa es la bioimpresión 3D que está en desarrollo todavía”.
Por otra parte, cabe señalar que Hermida y su equipo han creado hace ya varios años una malla para reparar la piel que llegó a pruebas preclínicas en animales grandes. En ese caso no se utilizó impresión 3D, sino fabricación de esponjas. La iniciativa obtuvo financiación pública de 2013 a 2015 y ellos extendieron el uso de fondos hasta 2018. Esperan poder percibir nuevos fondos, privados o públicos, para lograr terminar las pruebas y avanzar hacia los estadíos siguientes.
“Esto es competitivo a nivel internacional, porque lo que existe hoy en día en el mundo son membranas para regeneración dérmica y la que nosotros desarrollamos permite regenerar simultáneamente la dermis (profunda) y la epidermis (superficial)”, dice. Hermida asegura que es una técnica innovadora en la cual están trabajando apenas 4 o 5 grupos en todo el mundo, además de ellos.
Temas
Otras noticias de Impresoras 3D
 1
1El truco para conectar ChatGPT con Canva y crear presentaciones increíbles
 2
2OpenAI presenta los nuevos modelos o3 y o4-mini, los primeros con capacidad para “pensar con imágenes”
 3
3Studio Ghibli: las mejores imágenes del Domingo de Resurrección para mandar por WhatsApp
 4
4Para mandar por WhatsApp: los mejores emojis de Pascuas 2025
Últimas Noticias
Ahora para comentar debés tener Acceso Digital.
Iniciar sesión o suscribite






