Bacterias magnetotácticas: nanorrobots de origen biológico en la lucha contra el cáncer
- 5 minutos de lectura'
De acuerdo con los datos de la Organización Mundial de la Salud, el cáncer es la segunda causa de muerte más común en el mundo, con una tasa de mortalidad superior al 50 %. Su magnitud es tal que, de no considerarse estrategias alternativas, se prevé que el diagnóstico de nuevos casos anuales en Europa pase de los 3,5 millones actuales a más 4,3 millones en 2035.
Los tratamientos habituales para combatir esta enfermedad se basan en la combinación de cirugía, con la que se consigue eliminar el grueso del tumor, y radio y quimioterapia, utilizadas para atacar a las células cancerosas que persisten en el tejido tumoral. Estas terapias conllevan efectos colaterales que en muchas ocasiones perjudican la vida de los pacientes. Existe así la necesidad de explorar nuevas rutas para la lucha contra el cáncer, las cuales implican en la mayoría de los casos el uso de nanotecnología.
Es aquí donde se abre la puerta a la imaginación.
Los argumentos más extravagantes de películas de ciencia ficción pueden servir como inspiración para el desarrollo de nuevas estrategias de diagnóstico y tratamiento de enfermedades. Ya en los años 60 la película Viaje alucinante narraba la historia de una tripulación multidisciplinar que se embarca a bordo de un submarino micrométrico para salvar al protagonista del hematoma cerebral que le mantiene en coma. Pero, ¿es esto solo ciencia ficción?

En los últimos años, lo que pudiera parecer fantasía se ha convertido en realidad. El uso de nanorrobots en medicina ha atraído la atención de la comunidad científica y cada vez son más los que centran su investigación en este ámbito. La pregunta es ¿qué características debe tener un nanorrobot para ser el agente perfecto en terapias contra el cáncer? De forma general, debe ser capaz de autopropulsarse, reaccionar al entorno local, ser detectable, producir y transportar fármacos y localizar tumores.
Con el fin de satisfacer estas necesidades, en los últimos años, se han propuesto distintos tipos de nanorrobots. Desafortunadamente, los candidatos convencionales presentan ciertas limitaciones, siendo una de sus principales desventajas la necesidad de utilizar combustibles para su propulsión. Esto, además de ser un inconveniente en sí mismo, conlleva la generación de residuos indeseables.
Una corriente alternativa que está ganando popularidad es el uso de entes biológicos, como bacterias, con capacidades innatas de navegación e interacción con células y tejidos vivos. En los últimos años, la Food and Drug Administration (FDA) ha aprobado ensayos clínicos con distintas especies bacterianas demostrando resultados prometedores en la eliminación de tumores.
Más aún, actualmente existe un procedimiento médico establecido basado en la utilización de la especie Bacillus Calmette-Guerin (BCG) para el tratamiento de cáncer de vejiga. Sin embargo, una de las principales limitaciones en esta ocasión aparece con la dificultad de dirigir y detectar las bacterias una vez introducidas en el cuerpo humano.
En este sentido, existen unas bacterias aventajadas que presenta lo mejor de los dos mundos: las bacterias magnetotácticas.
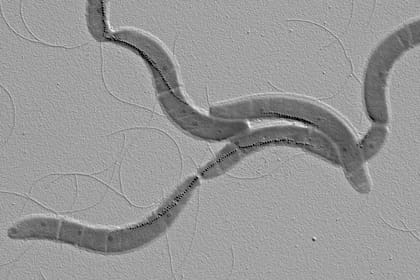
Bacterias con una brújula natural
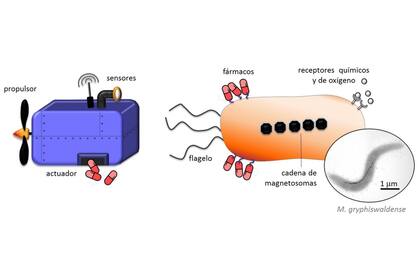
Las bacterias magnetotácticas son un grupo muy diverso de microorganismos acuáticos capaces de sintetizar naturalmente en su interior una cadena de nanopartículas magnéticas, denominadas magnetosomas. Esta cadena juega el papel de una brújula que permite a las bacterias orientarse en el campo magnético terrestre mientras nadan activamente, gracias a la presencia de uno o más flagelos, facilitando su búsqueda de nutrientes.
Al mismo tiempo, son seres microanaerobios con elementos sensores que les guían a zonas con una baja concentración de oxígeno. Por todo ello, muestran un potencial sin igual para su utilización como bionanorobots (nanobiots) puesto que es posible guiarlas y manipularlas mediante la aplicación de campos magnéticos externos mientras que presentan una atracción natural hacía zonas hipóxicas, como son las regiones tumorales a causa de la falta de riego sanguíneo.
Además, pueden ser utilizadas para diagnóstico y tratamiento contra el cáncer.
Para diagnóstico, la cadena de magnetosomas actúa como agente de contraste magnético natural para localizar tumores mediante imagen de resonancia magnética utilizando los dispositivos ya disponibles en nuestros hospitales.
Como agentes terapéuticos, la gran ventaja de las bacterias magnetotácticas es su potencial en tratamientos de hipertermia magnética, una técnica utilizada para combatir el cáncer que fue aprobada en Europa en 2011 como medida complementaria a la quimio y radioterapia para el tratamiento de tumores cerebrales.
La hipertermia magnética está basada en el aumento local de la temperatura hasta 42 °C exclusivamente en la zona tumoral, debilitando las células cancerosas sin afectar a los tejidos sanos. Este aumento de la temperatura se consigue dirigiendo a estas bacterias a la zona tumoral y sometiéndolas a un campo magnético alterno externo, el cual produce una disipación de calor característica de nanopartículas magnéticas (como son los magnetosomas).
Por último, para que el tratamiento sea más efectivo, las bacterias magnetotácticas son fáciles de funcionalizar tanto con ligandos específicos de las células diana como con fármacos utilizados comúnmente en el tratamiento del cáncer. Esto quiere decir que las bacterias se unirían de manera específica al tumor descargando los fármacos únicamente en la zona afectada. Así se conseguiría un tratamiento más específico, y por lo tanto eficaz del tumor, minimizando el daño colateral de células sanas.
Desde el Grupo de Magnetismo y Materiales Magnéticos trabajamos mezclando microbiología y física para el estudio de las MTB y su aplicación como nanobiots en el tratamiento contra el cáncer. El carácter multidisciplinar del grupo de investigación, como si de la tripulación del submarino se tratase, nos permite tanto estudiar y optimizar las características fundamentales de diferentes especies de bacterias magnetotácticas como realizar estudios in vitro con diferentes cepas de células cancerosas.
Lucía Gandarias es Personal Investigador en Formación en el Departamento de Inmunología, Microbiología y Parasitología, Universidad del País Vasco. Lourdes Marcano es Investigadora Postdoctoral en el Grupo de Magnetismo y Materiales Magnéticos (GMMM), Universidad del País Vasco
Esta nota se republica de The Conversation bajo licencia Creative Commons










