Inventó una revolucionaria herramienta para modificar el genoma y salvó la vida de una niña con un cáncer muy agresivo
El químico David Liu recibe entre cinco y diez cartas de padres de chicos con enfermedades genéticas por semana para que los ayude
- 10 minutos de lectura'
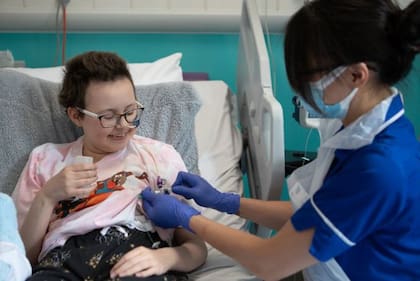
MADRID.– La revista de la Universidad de Harvard publicó hace casi un par de décadas que a uno de sus profesores, el químico David Liu, le habían prohibido la entrada en unos casinos de Las Vegas cuando tenía 29 años, tras ganar demasiado dinero jugando al blackjack. Preguntado sobre si es una leyenda urbana, Liu sonríe. “Es parcialmente cierto. En realidad tenía 21 años y no fue solamente una noche”, responde entre carcajadas. El químico fue un joven prodigio. Con 26 años era profesor en Harvard; con 31 ya era catedrático. Como diversión, utilizaba las matemáticas mentalmente para tener ventaja en el juego de naipes en el que gana quien suma 21 puntos. Cuando tenía 43 años, en 2016, su equipo inventó los editores de bases, una herramienta para modificar el ADN con precisión que está revolucionando la medicina. Hace tres meses, un hospital de Londres anunció que había utilizado los editores de bases para salvar la vida de Alyssa, una niña de 13 años con una leucemia muy agresiva.
“Su cáncer está en remisión completa”, celebra Liu. El manual de funcionamiento de un ser humano, presente en cada célula, es un texto con más de 3000 millones de letras químicas. Los errores en este ADN provocan el cáncer y multitud de enfermedades. Liu quiere reescribir este libro humano para eliminar las erratas. El químico californiano, nacido en Riverside hace 49 años, compara sus editores de bases con un lápiz con una goma de borrar, capaz de eliminar una sola letra y sustituirla por otra.
El equipo médico de Alyssa, del University College de Londres, empleó los editores de bases para modificar glóbulos blancos de un donante y ayudar a que atacasen a las células del cáncer de la niña. Las asombrosas técnicas de David Liu dejaron desfasadas las herramientas de edición genética anteriores, incluso las conocidas como CRISPR, inventadas en 2012 y ganadoras del Nobel de Química de 2020. El investigador compara las CRISPR originales con unas tijeras, útiles para inactivar genes de manera tosca, pero no para reescribir con precisión. Su propio lápiz con goma ya está siendo superado. En 2019, Liu anunció una nueva herramienta: la edición de calidad. “Es como un procesador de texto: puedes buscar una secuencia específica y sustituirla entera por otra secuencia que tú quieras”, explica por videoconferencia. Sus editores de calidad, todavía en fase experimental, pueden teóricamente corregir el 89% de las 75.000 variantes genéticas asociadas a enfermedades.
-Hay 20 millones de nuevos casos de cáncer cada año en el mundo. ¿Cuántos de estos pacientes podrían beneficiarse de los editores de bases o de los editores de calidad?
-El cáncer no es una enfermedad, son cientos de enfermedades. Y cada una de ellas presenta diferentes cambios moleculares que lo provocan. Creo que la estrategia utilizada con Alyssa es muy prometedora para pacientes con leucemia de las células T y posiblemente para otros tumores de la sangre, pero es muy pronto para saber qué papel pueden desempeñar estas herramientas en otros tipos de cáncer.
-Esto parecía ciencia ficción en 2016, incluso para usted.
-Estos editores de bases y editores de calidad no existen en la naturaleza. Son máquinas moleculares diseñadas. Me parece increíble que los seres humanos estemos tomando tan rápido el control de nuestros genomas y de las faltas de ortografía que provocan las enfermedades genéticas.
-Hay 400 millones de personas afectadas por alguna de las 7000 enfermedades causadas por mutaciones en un solo gen. Su colega Fyodor Urnov, de la Universidad de California en Berkeley, se preguntaba hace tres meses: “¿Por qué no las estamos curando ya?”. Él sostiene que los principales obstáculos no son técnicos, sino legales, financieros y de organización.
-Estoy de acuerdo. Todavía hay desafíos técnicos y científicos importantes, como aprender a modificar el ADN de maneras que serían terapéuticas, pero que no sabemos hacer. Y, por supuesto, todavía no sabemos cómo llegar a determinados tejidos del cuerpo. Pero estoy de acuerdo con Fyodor en que existen barreras de fabricación, regulatorias y otras no científicas, que habrá que abordar si queremos maximizar el beneficio de estas tecnologías para la sociedad.
-¿Va a morir mucha gente por obstáculos que no son científicos?
-Si alguien muere por una enfermedad, la culpa es de la enfermedad, no de los organismos reguladores. Los reguladores no matan a nadie. El objetivo es garantizar que estos tratamientos sean lo más eficaces que sea posible, pero también que sean seguros. La historia de la medicina está plagada de ejemplos en los que médicos y científicos bienintencionados no comprendieron suficientemente bien los efectos secundarios de sus terapias experimentales y acabaron perjudicando a los pacientes. El objetivo es evitar que esto ocurra.
-¿Usted cuántas cartas recibe de padres con niños con enfermedades genéticas?
-Unas cinco o diez cartas cada semana. Intentamos responder a todas. En los inicios de los editores de bases, la tecnología podía arreglar pocas de las mutaciones de una sola letra que nos contaban, pero ahora casi siempre existe una tecnología para corregir el error, ya sea con editores de bases o con editores de calidad. En algunos casos, sin embargo, no se demostró que corregir el error pueda realmente curar al paciente. En algunas enfermedades genéticas es tarde, porque el daño aparece muy pronto. En muchos casos, por desgracia, tengo que explicar a las personas que nos envían las cartas que hace falta una ciencia muy sólida para vincular una mutación genética a una enfermedad. Y también necesitas buenos modelos animales que imiten esa enfermedad. Para la mayoría de estas enfermedades no hay, por lo que es difícil probar si la edición genética puede funcionar. Y, por supuesto, aunque haya modelos animales, necesitas años de trabajo para demostrar que corregir una mutación puede corregir la enfermedad. Comprendo que pueda ser frustrante para la familia de un paciente saber que conocemos una tecnología que puede corregir un error en el ADN que podría ser la causa de la enfermedad genética que afecta a su hijo o a su hija. Sin embargo, la tecnología de edición genética no es suficiente por sí sola. Así que la buena noticia es que ya tenemos tecnologías que pueden corregir la inmensa mayoría de los errores en el ADN que causan las enfermedades genéticas conocidas. Pero, aunque este es un paso importante, necesitamos el resto de pasos para desarrollar estrategias terapéuticas.

-Urnov, en el mismo artículo publicado en The New York Times, calculaba que se necesitan cuatro años y unos 10 millones de dólares para obtener un fármaco de edición genética.
-Diez millones suena correcto, incluso es una cifra baja. Yo diría que puede costar entre un millón y 100 millones de dólares. Y cuatro años me parece muy rápido. Me parece un plazo ambicioso para comenzar un ensayo clínico, pero no para obtener la autorización de un fármaco. Es un punto de vista importante, para que la gente se dé cuenta de que, cuando leen una noticia de que un tratamiento funciona en un animal, todavía faltan años de trabajo para que ese tratamiento esté disponible para los pacientes.
-¿Quién puede invertir 10 millones de dólares para desarrollar un fármaco que solo se puede utilizar en una persona con una mutación específica?
-Esa es una de las principales cuestiones a las que se enfrenta nuestro campo. Ya estamos trabajando en algunas estrategias para intentar resolver este problema. Creo que hay algunas maneras de utilizar un agente de edición genética para tratar muchas mutaciones diferentes e incluso muchas enfermedades genéticas diferentes. Espero que podamos informar pronto de algunas novedades al respecto.
-Después de la remisión del cáncer de Alyssa, ¿qué será lo próximo?
-Hay cuatro ensayos clínicos en marcha con editores de bases. Uno de ellos es el de Alyssa, del University College de Londres. El primer ensayo que va a administrar editores de bases directamente en los pacientes [no en sus células en el laboratorio] es una colaboración entre las empresas Verve y Beam, para reducir niveles altísimos de colesterol malo relacionados con el gen PCSK9. El ensayo Beam-101, contra la enfermedad de células falciformes y la beta talasemia, ya está reclutando pacientes. Y también hay en marcha otro ensayo clínico en China para tratar la beta talasemia. Espero que Alyssa sea el preludio de muchos más resultados positivos.
-¿Cuándo se probarán los editores de calidad en un ensayo clínico en humanos?
-Habría que preguntar a Prime Medicine, la empresa que está desarrollando tratamientos con editores de calidad. Esperan tener un fármaco en fase de investigación en 2024, así que espero que los ensayos clínicos empiecen pronto, en pocos años [David Liu es cofundador de las empresas Beam Therapeutics y de Prime Medicine].
-¿Cómo se imagina usted la medicina dentro de 10 años?
-Me sentiría decepcionado si, dentro de 10 años, no tuviéramos bastantes ensayos clínicos, tanto con los editores de bases como con los editores de calidad. Y espero que tengamos los primeros fármacos aprobados que sean máquinas moleculares capaces de ir a la célula de un paciente y cambiar específicamente un error que cause una enfermedad genética. O, como están haciendo las empresas Verve y Beam, introducir un cambio preciso que disminuya tu riesgo de padecer una enfermedad grave. Si hacemos otra entrevista en 2033 espero que estén aprobados los primeros fármacos que nos permitan tomar el control de nuestros genomas, sin depender tanto de errores en nuestro ADN que determinan el destino genético de tantos millones de personas.
-Usted tuiteó el otro día que las personas somos accidentes felices.
-Me refería al azar en la evolución. Los organismos evolucionan y sus mutaciones son parcialmente al azar. Que un gen evolucione de una manera o de otra se puede considerar un accidente feliz. La evolución depende de sucesos fortuitos que hacen que los resultados sean estocásticos, difíciles de predecir. En ese sentido, el hecho de que los humanos hayan evolucionado como lo han hecho es un poco una cuestión de suerte, o de mala suerte, según la perspectiva de cada uno. Como dijo [el biólogo estadounidense] Stephen Jay Gould, si rebobinas la película de la vida y vuelves a empezar desde el primer organismo en la sopa primigenia, volviendo a ver la evolución durante miles de millones de años, me sorprendería que todo acabe con nosotros hablando en esta entrevista. Hay abrumadoras probabilidades de que acabase con resultados muy diferentes.
There is stochasticity in evolution for sure, driven by the random nature of some mutagenesis processes and diverged further via epistasis. We see this even when we repeat parallel evolutions in PACE of gene editing agents, proteases, etc. In many ways we are all happy accidents.
— David R. Liu (@davidrliu) January 20, 2023
-Entonces, ¿usted no ve la mano de un Dios en ninguna parte en el ADN?
-Es una pregunta difícil de responder. Sin comentarios [risas].
-Usted apoyó una moratoria sobre la edición de la línea germinal [modificaciones heredables que se llevan a cabo en los óvulos, en los espermatozoides o en los propios embriones cuando son solo una célula], para impedir la creación de bebés modificados genéticamente. Fue en 2019. ¿Todavía apoya la moratoria?
-No es una cuestión sencilla de blancos y negros, como en la mayoría de los asuntos importantes, pero creo que actualmente hay muy pocas razones para editar la línea germinal. Sí preveo que en el futuro habrá más casos, especialmente cuando ya se haya probado más la edición de células somáticas [células que no son ni óvulos ni espermatozoides] e incluso haya fármacos aprobados. Ese podría ser un mejor momento para analizar las ventajas y los inconvenientes de la edición genética de la línea germinal. Por ahora, creo que los riesgos éticos y científicos son demasiado altos como para justificar el escaso número de casos hipotéticos en los que se podría considerar necesaria la edición de la línea germinal.
-¿Qué tipo de casos se imagina en el futuro?
-Bueno, en el futuro puede haber mayor voluntad de editar la línea germinal. Una vez que la edición genética de células somáticas esté lo suficientemente madura como para que haya un alto grado de confianza en su seguridad y eficacia, creo que la gente, con naturalidad, volverá a plantearse la edición de la línea germinal. Actualmente, no creo que deba ser una prioridad.
Por Manuel Ansede
©EL PAÍS, SL
Otras noticias de Genética
 1
1En la ciudad. Lanzan un programa para que los mayores de 25 terminen el secundario en un año: cómo inscribirse
 2
2Ya tiene fecha el comienzo del juicio a la enfermera acusada de asesinar a seis bebés
- 3
Por qué los mayores de 60 años no deberían tomar vitamina D
 4
4¿El mate nos hace más felices? El sorprendente descubrimiento de un estudio científico





