Coronavirus: Moderna anuncia que su vacuna es “altamente efectiva” en adolescentes
La empresa enviará sus ensayos clínicos a los reguladores para obtener autorización de uso de emergencia en junio
 3 minutos de lectura'
3 minutos de lectura'

WASHINGTON.- La empresa de biotecnología estadounidense Moderna anunció que su vacuna contra el coronavirus es efectiva en adolescentes de entre 12 y 17 años tras obtener resultados positivos en los ensayos clínicos, lo que permitiría el escenario para la fase de autorización que se prevé para junio.
La firma, cuyo fármaco está autorizado por el momento únicamente para adultos mayores a 18 años, dijo que presentará los hallazgos de su estudio a la Administración de Medicamentos y Alimentos (FDA) de Estados Unidos y otros reguladores del mundo para su autorización de uso de emergencia a principios de junio.
Si Moderna recibe el mismo proceso de autorización que se llevó a cabo con otras vacunas como Pfizer/BioNTech - que demoró cerca de un mes- se espera la aprobación para julio.
“Nos alienta que el ARNm-1273 sea muy eficaz para prevenir el COVID-19 en los adolescentes. Es particularmente emocionante ver que la vacuna Moderna COVID-19 puede prevenir la infección por SARS-CoV-2 “, dijo Stéphane Bancel, director ejecutivo de Moderna.

“Enviaremos estos resultados la FDA y los reguladores a nivel mundial a principios de junio y solicitar autorización. Seguimos comprometidos en hacer nuestra parte para ayudar a poner fin a la pandemia de COVID-19 “, agregó en un comunicado oficial.
La mayoría de los niños que contraen el virus suelen tener síntomas leves o incluso no desarrollan síntomas, pero aún así corren el riesgo de enfermarse gravemente y de transmitir la enfermedad.
Las dosis para los menores son una garantía para las escuelas y campamentos en Estados Unidos relajen las medidas de uso de mascarillas y distanciamiento sociales recomendadas por el Centro para el Control y la Prevención de Enfermedades (CDC).
“Hasta la fecha, no se han identificado problemas de seguridad importantes. La mayoría de los eventos adversos fueron de gravedad leve o moderada”, informó el reporte.
Durante los ensayos, el síntoma adverso tras la dosis más común que detectaron los investigadores fue el dolor en el lugar de la inyección. Tras la segunda dosis, los síntomas más comunes fueron dolor de cabeza, fatiga, mialgia y escalofríos, según el estudio.
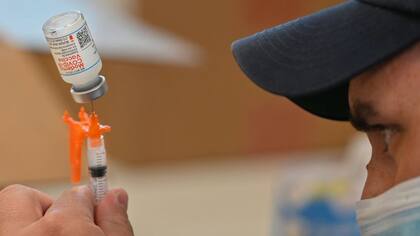
La vacuna fue testeada en 3732 adolescentes, dos tercios de los cuales recibieron la vacuna y un tercio, un placebo. El objetivo principal era generar una respuesta inmune no menor que la experimentada en el ensayo de fase 3 en adultos, que tuvo una efectividad de 94,1% en la prevención del Covid-19.
Dos semanas después de la segunda dosis, los investigadores no encontraron casos de coronavirus en el grupo de la vacuna en comparación con 4 casos en el grupo de placebo, lo que resultó en una eficacia de la vacuna del 100%, según las definiciones de casos del ensayo en adultos de la compañía.
Luego, ampliando a una definición de caso de la CDC, que requiere sólo un síntoma del virus, se encontró que la vacuna tiene una efectividad del 93%, lo que sugiere que puede proteger contra casos con síntomas más leves, dijo la compañía.
Todos los participantes del estudio serán monitoreados durante 12 meses después de su segunda dosis para determinar la protección y seguridad a largo plazo. “En consecuencia, estos datos están sujetos a cambios según la recopilación de datos en curso”, advirtió la firma.
Agencias Reuters y AFP
Otras noticias de Vacuna contra el coronavirus
- 1
La emoción de Trudeau en plena tensión con Trump y antes de dejar el poder: “El honor de mi vida”
- 2
Trump amenaza a Rusia tras un bombardeo a gran escala en Ucrania, pero le hace un guiño a Putin
 3
3Por primera vez desde que lo internaron, los médicos hablan de “una buena respuesta a la terapia” del Papa
- 4
Un año y medio de prisión por matar a una rata: los insólitos alcances de una nueva ley sobre animales en España



