Un estudio indica que la posibilidad de producir hidrógeno del agua está cada vez más cerca
La producción en masa eficiente de hidrógeno a partir del agua está más cerca de convertirse en realidad, gracias a un nuevo estudio publicado en Science Advances.
Investigadores de la Facultad de Ingeniería de la Universidad Estatal de Oregón (OSU) y colaboradores de la Universidad de Cornell y el Argonne National Laboratory utilizaron herramientas experimentales avanzadas para forjar una comprensión más clara de un proceso catalítico electroquímico que es más limpio y más sostenible que derivar hidrógeno del gas natural.
El hidrógeno se encuentra en una amplia gama de compuestos en la Tierra, más comúnmente combinándose con oxígeno para producir agua, y tiene muchas funciones científicas, industriales y relacionadas con la energía. También se presenta en forma de hidrocarburos, compuestos formados por hidrógeno y carbono como el metano, el componente principal del gas natural.
"La producción de hidrógeno es importante para muchos aspectos de nuestra vida, como las pilas de combustible para automóviles y la fabricación de muchos productos químicos útiles como el amoníaco", explicó Zhenxing Feng, profesor de ingeniería química del estado de Oregon que dirigió el estudio y agregó: "También se utiliza en el refinado de metales, para producir materiales artificiales como plásticos y para una variedad de otros fines".
Según el Departamento de Energía, Estados Unidos produce la mayor parte de su hidrógeno a partir de una fuente de metano, como el gas natural, mediante una técnica conocida como reformado con vapor de metano. El proceso implica someter el metano a vapor presurizado en presencia de un catalizador, creando una reacción que produce hidrógeno y monóxido de carbono, así como una pequeña cantidad de dióxido de carbono.
El siguiente paso se denomina reacción de cambio de agua-gas en la que el monóxido de carbono y el vapor reaccionan mediante un catalizador diferente, produciendo dióxido de carbono e hidrógeno adicional. En el último paso, se eliminan la adsorción por cambio de presión, el dióxido de carbono y otras impurezas, dejando atrás hidrógeno puro.
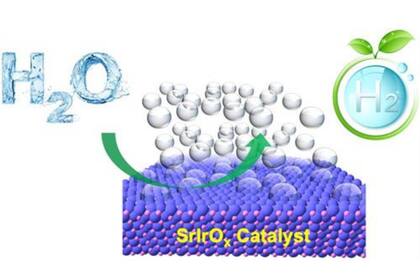
"En comparación con el reformado de gas natural, el uso de electricidad de fuentes renovables para dividir el agua en hidrógeno es más limpio y más sostenible", comentó Feng en un comunicado. Al mismo tiempo, sostuvo: "Sin embargo, la eficiencia de la división del agua es baja, principalmente debido al alto sobrepotencial (la diferencia entre el potencial real y el potencial teórico de una reacción electroquímica) de una semirreacción clave en el proceso, la reacción de desprendimiento de oxígeno o REA".

Una semirreacción es una de las dos partes de una reacción redox, o de reducción-oxidación, en la que se transfieren electrones entre dos reactivos; la reducción se refiere a la obtención de electrones, la oxidación significa la pérdida de electrones. El concepto de semirreacciones se usa a menudo para describir lo que sucede en una celda electroquímica, y las semirreacciones se usan comúnmente como una forma de equilibrar las reacciones redox. El sobrepotencial es el margen entre el voltaje teórico y el voltaje real necesario para provocar la electrólisis, una reacción química impulsada por la aplicación de corriente eléctrica.
"Los electrocatalizadores son fundamentales para promover la reacción de división del agua al reducir el sobrepotencial, pero el desarrollo de electrocatalizadores de alto rendimiento está lejos de ser sencillo", aclaró Feng. Por otra parte manifestó que "uno de los principales obstáculos es la falta de información sobre la estructura evolutiva de los electrocatalizadores durante las operaciones electroquímicas. Comprender la evolución estructural y química del electrocatalizador durante los REA es esencial para desarrollar materiales electrocatalizadores de alta calidad y, a su vez, energía sustentabilidad".
Feng y sus colaboradores utilizaron un conjunto de herramientas de caracterización avanzadas para estudiar la evolución estructural atómica de un electrocatalizador REA de última generación, iridato de estroncio (SrIrO3), en un electrolito ácido. "Queríamos comprender el origen de su actividad récord para los REA: 1.000 veces mayor que el catalizador comercial común, el óxido de iridio", dijo Feng.
Al mismo tiempo, el especialista argumentó: "Utilizando instalaciones de rayos X basadas en sincrotrón en Argonne y espectroscopia de fotoelectrones de rayos X basada en laboratorio en el sitio de Infraestructura de Nanotecnología del Noroeste en OSU, observamos la transformación química superficial y cristalina a amorfa de SrIrO3 durante los REA".
Las observaciones llevaron a una comprensión profunda de lo que estaba sucediendo detrás de la capacidad del iridato de estroncio para funcionar tan bien como catalizador. "Nuestro hallazgo detallado a escala atómica explica cómo se forma la capa de iridato de estroncio activo en el iridato de estroncio y apunta al papel crítico de la activación del oxígeno reticular y la difusión iónica acoplada en la formación de las unidades REA activas", amplió.
Feng agregó que el trabajo proporciona información sobre cómo el potencial aplicado facilita la formación de las capas amorfas funcionales en la interfaz electroquímica y conduce a posibilidades para el diseño de mejores catalizadores.